Menselijk bèta-amyloïde (1-42) eiwit, ook bekend als Aβ 1-42, is een sleutelfactor bij het ontrafelen van de mysteries van de ziekte van Alzheimer.Dit peptide speelt een centrale rol bij de vorming van amyloïde plaques, raadselachtige clusters die de hersenen van Alzheimerpatiënten beschadigen.Met een destructief effect verstoort het de neuronale communicatie, veroorzaakt het ontstekingen en veroorzaakt het neurotoxiciteit, wat leidt tot cognitieve stoornissen en neurale schade.Het onderzoeken van de aggregatie- en toxiciteitsmechanismen ervan is niet alleen van cruciaal belang;het is een spannende reis naar het oplossen van de puzzel van Alzheimer en het ontwikkelen van toekomstige therapieën.



Aβ 1-42 is een peptidefragment van 42 aminozuren dat is afgeleid van de splitsing van het amyloïde precursoreiwit (APP) door β- en γ-secretasen.Aβ 1-42 is een van de belangrijkste componenten van de amyloïde plaques die zich ophopen in de hersenen van patiënten met de ziekte van Alzheimer, een neurodegeneratieve aandoening die wordt gekenmerkt door cognitieve stoornissen en geheugenverlies.Er is aangetoond dat Aβ 1-42 verschillende functies en toepassingen heeft in biologisch en biomedisch onderzoek, zoals:
1. Neurotoxiciteit: Aβ 1-42 kan oplosbare oligomeren vormen die in staat zijn zich te binden aan neuronale membranen, receptoren en synapsen en deze te verstoren.Deze oligomeren kunnen ook oxidatieve stress, ontstekingen en apoptose in neuronen veroorzaken, wat leidt tot synaptisch verlies en neuronale dood.Aβ 1-42-oligomeren worden als neurotoxischer beschouwd dan andere vormen van Aβ, zoals Aβ 1-40, de meest voorkomende vorm van Aβ in de hersenen.Er wordt ook gedacht dat Aβ 1-42-oligomeren zich van cel naar cel kunnen voortplanten, vergelijkbaar met prionen, en de verkeerde vouwing en aggregatie van andere eiwitten kunnen veroorzaken, zoals tau, dat neurofibrillaire kluwens vormt bij de ziekte van Alzheimer.
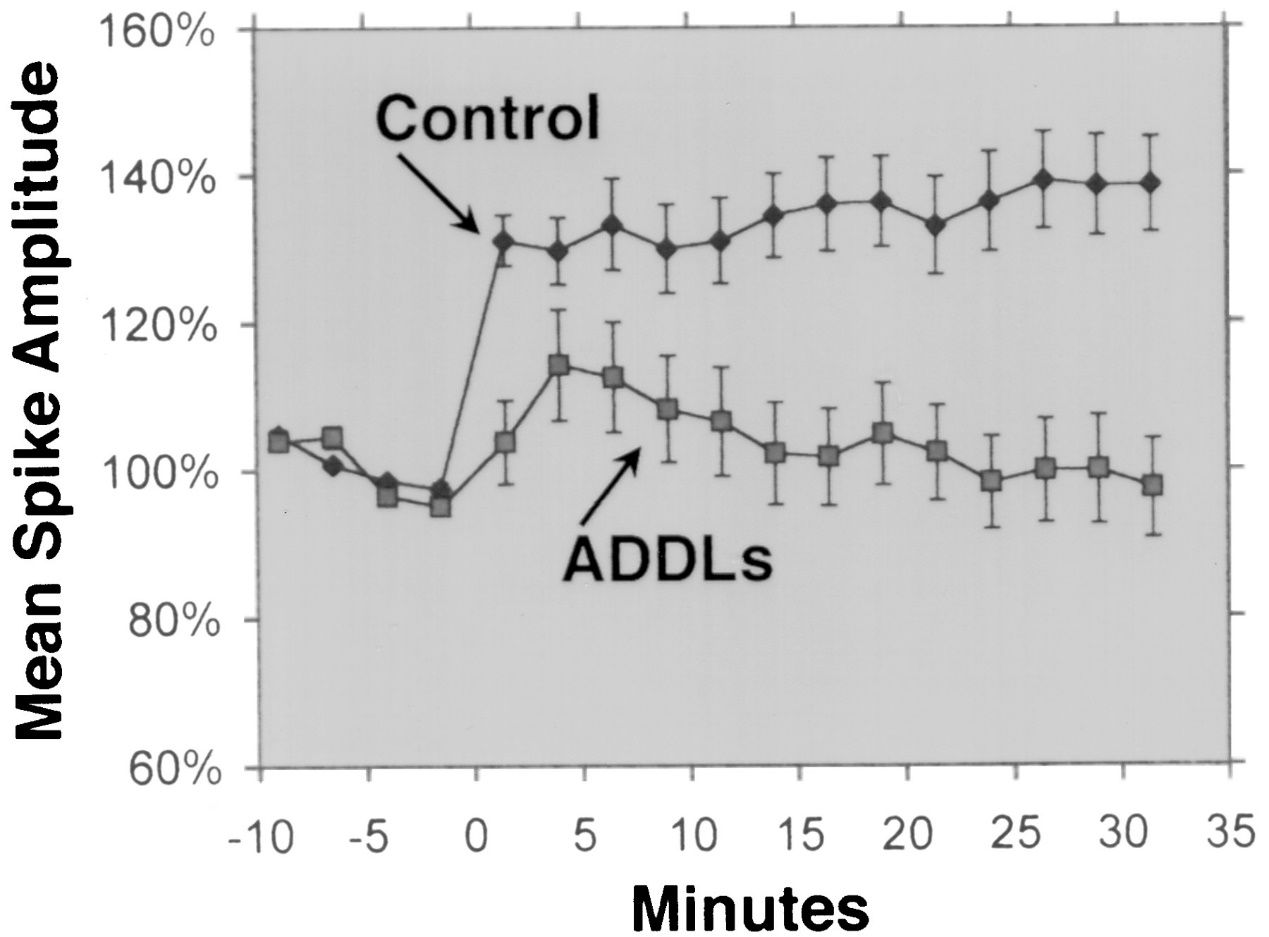
Aβ 1-42 wordt algemeen beschouwd als de Aβ-isovorm met de hoogste neurotoxiciteit.Verschillende experimentele onderzoeken hebben de neurotoxiciteit van Aβ 1-42 aangetoond met behulp van verschillende methoden en modellen.Lesné et al.(Brain, 2013) onderzochten de vorming en toxiciteit van Aβ-oligomeren, die oplosbare aggregaten van Aβ-monomeren zijn, en toonden aan dat Aβ 1-42-oligomeren een sterker schadelijk effect hadden op neuronale synapsen, wat leidde tot cognitieve achteruitgang en neuronaal verlies.Lambert et al.(Proceedings of the National Academy of Sciences, 1998) benadrukte de neurotoxiciteit van Aβ 1-42-oligomeren en ontdekte dat ze een sterk toxisch effect hadden op het centrale zenuwstelsel, mogelijk door synapsen en neurotransmitters te beïnvloeden.Walsh et al.(Nature, 2002) toonden het remmende effect aan van Aβ 1-42-oligomeren op de langetermijnpotentiëring (LTP) van de hippocampus in vivo, een cellulair mechanisme dat ten grondslag ligt aan leren en geheugen.Deze remming werd geassocieerd met geheugen- en leerstoornissen, wat de impact van Aβ 1-42-oligomeren op synaptische plasticiteit benadrukte.Shankar et al.(Nature Medicine, 2008) isoleerden Aβ 1-42-dimeren rechtstreeks uit de hersenen van Alzheimer en toonden hun effect op de synaptische plasticiteit en het geheugen aan, wat empirisch bewijs leverde voor de neurotoxiciteit van Aβ 1-42-oligomeren.
Bovendien hebben Su et al.(Molecular & Cellular Toxicology, 2019) voerden transcriptomics- en proteomics-analyse uit van door Aβ 1-42 geïnduceerde neurotoxiciteit in SH-SY5Y-neuroblastoomcellen.Ze identificeerden verschillende genen en eiwitten die werden beïnvloed door Aβ 1-42 in routes die verband houden met het apoptotische proces, eiwittranslatie, het katabole proces van cAMP en de reactie op endoplasmatisch reticulumstress.Takeda et al.(Biological Trace Element Research, 2020) onderzocht de rol van extracellulair Zn2+ bij door Aβ 1-42 geïnduceerde neurotoxiciteit bij de ziekte van Alzheimer.Ze toonden aan dat de door Aβ 1-42 geïnduceerde intracellulaire Zn2+-toxiciteit versneld werd bij veroudering vanwege de leeftijdsgerelateerde toename van extracellulair Zn2+.Ze suggereerden dat Aβ 1-42, continu uitgescheiden door neuronterminals, leeftijdsgerelateerde cognitieve achteruitgang en neurodegeneratie veroorzaakt via intracellulaire Zn2+-ontregeling.Deze onderzoeken suggereren dat Aβ 1-42 een sleutelfactor is bij het mediëren van neurotoxiciteit en ziekteprogressie bij de ziekte van Alzheimer door verschillende moleculaire en cellulaire processen in de hersenen te beïnvloeden.
2. Antimicrobiële activiteit: Er is gerapporteerd dat Aβ 1-42 antimicrobiële activiteit heeft tegen verschillende pathogenen, zoals bacteriën, schimmels en virussen.Aβ 1-42 kan zich binden aan de membranen van microbiële cellen en deze verstoren, wat leidt tot hun lyse en dood.Aβ 1-42 kan ook het aangeboren immuunsysteem activeren en ontstekingscellen naar de infectieplaats rekruteren.Sommige onderzoeken hebben gesuggereerd dat de ophoping van Aβ in de hersenen een beschermende reactie kan zijn op chronische infecties of verwondingen.Overmatige of ontregelde productie van Aβ kan echter ook bijkomende schade aan de gastheercellen en -weefsels veroorzaken.
Er is gerapporteerd dat Aβ 1-42 antimicrobiële activiteit vertoont tegen een reeks pathogenen, zoals bacteriën, schimmels en virussen, zoals Staphylococcus aureus, Escherichia coli, Candida albicans en Herpes simplex-virus type 1, door interactie met hun membranen en waardoor hun verstoring en lyse ontstaat.Kumar et al.(Journal of Alzheimer's Disease, 2016) heeft dit effect aangetoond door aan te tonen dat Aβ 1-42 de membraanpermeabiliteit en morfologie van microbiële cellen veranderde, wat tot hun dood leidde.Naast de directe antimicrobiële werking kan Aβ 1-42 ook de aangeboren immuunrespons moduleren en ontstekingscellen naar de plaats van infectie rekruteren.Socia et al.(PLoS One, 2010) onthulde deze rol door te rapporteren dat Aβ 1-42 de productie van pro-inflammatoire cytokinen en chemokinen stimuleerde, zoals interleukine-6 (IL-6), tumornecrosefactor-alfa (TNF-α), monocyten chemoattractant eiwit-1 (MCP-1) en macrofaag inflammatoir eiwit-1 alfa (MIP-1α), in microglia en astrocyten, de belangrijkste immuuncellen in de hersenen.
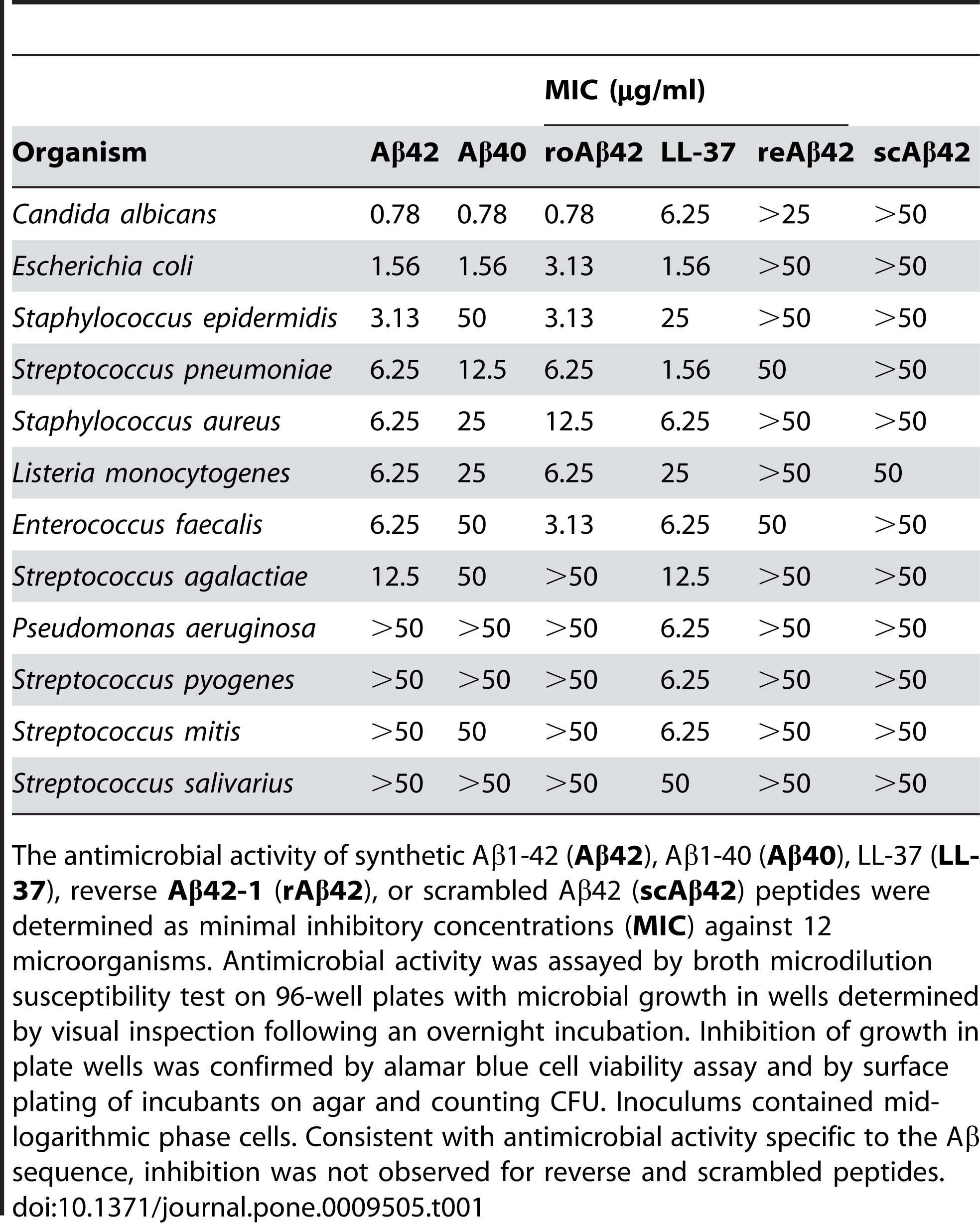
Figuur 2. Aβ-peptiden bezitten antimicrobiële activiteit.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. Het met de ziekte van Alzheimer geassocieerde amyloïde bèta-eiwit is een antimicrobieel peptide. PLoS One 3 maart 2010;5(3):e9505.)
Hoewel sommige onderzoeken hebben gesuggereerd dat de ophoping van Aβ in de hersenen een beschermende reactie kan zijn op chronische infecties of verwondingen, omdat Aβ kan werken als een antimicrobieel peptide (AMP) en potentiële ziekteverwekkers kan elimineren, blijft de complexe wisselwerking tussen Aβ en microbiële elementen een probleem. onderwerp van onderzoek.Het delicate evenwicht wordt benadrukt door het onderzoek van Moir et al.(Journal of Alzheimer's Disease, 2018), wat suggereert dat een onevenwichtige of overmatige Aβ-productie onbedoeld schade kan toebrengen aan de gastheercellen en -weefsels, wat de ingewikkelde dubbele aard van de rol van Aβ bij infectie en neurodegeneratie weerspiegelt.Overmatige of ontregelde productie van Aβ kan leiden tot aggregatie en afzetting ervan in de hersenen, waardoor giftige oligomeren en fibrillen worden gevormd die de neuronale functie aantasten en neuro-inflammatie veroorzaken.Deze pathologische processen worden geassocieerd met cognitieve achteruitgang en geheugenverlies bij de ziekte van Alzheimer, een neurodegeneratieve aandoening die wordt gekenmerkt door progressieve dementie.Daarom is de balans tussen de gunstige en schadelijke effecten van Aβ cruciaal voor het behoud van de gezondheid van de hersenen en het voorkomen van neurodegeneratie.
3. Ijzerexport: Er is aangetoond dat Aβ 1-42 betrokken is bij de regulatie van ijzerhomeostase in de hersenen.IJzer is een essentieel element voor veel biologische processen, maar een teveel aan ijzer kan ook oxidatieve stress en neurodegeneratie veroorzaken.Aβ 1-42 kan zich aan ijzer binden en de export ervan uit neuronen vergemakkelijken via ferroportine, een transmembraanijzertransporteur.Dit kan ijzerophoping en toxiciteit in de hersenen helpen voorkomen, omdat overtollig ijzer oxidatieve stress en neurodegeneratie kan veroorzaken.Duce et al.(Cell, 2010) meldde dat Aβ 1-42 zich aan ferroportine bond en de expressie en activiteit ervan in neuronen verhoogde, wat leidde tot verlaagde intracellulaire ijzerniveaus.Ze toonden ook aan dat Aβ 1-42 de expressie van hepcidine, een hormoon dat ferroportine remt, in astrocyten verminderde, waardoor de ijzerexport uit neuronen verder werd verbeterd.IJzergebonden Aβ kan echter ook gevoeliger worden voor aggregatie en afzetting in de extracellulaire ruimte, waardoor amyloïde plaques worden gevormd.Ayton et al.(Journal of Biological Chemistry, 2015) meldde dat ijzer de vorming van Aβ-oligomeren en fibrillen in vitro en in vivo bevorderde.Ze toonden ook aan dat ijzerchelatie de Aβ-aggregatie en afzetting in transgene muizen verminderde.Daarom is de balans tussen de gunstige en schadelijke effecten van Aβ 1-42 op de ijzerhomeostase cruciaal voor het behouden van de gezondheid van de hersenen en het voorkomen van neurodegeneratie.
Wij zijn een polypeptidefabrikant in China, met meerdere jaren volwassen ervaring in de productie van polypeptiden.Hangzhou Taijia Biotech Co., Ltd. is een professionele fabrikant van polypeptidegrondstoffen, die tienduizenden polypeptidegrondstoffen kan leveren en ook kan worden aangepast aan de behoeften.De kwaliteit van polypeptideproducten is uitstekend en de zuiverheid kan 98% bereiken, wat door gebruikers over de hele wereld wordt erkend. Welkom om ons te raadplegen.






